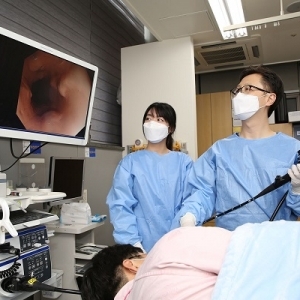
[박광준 기자] 정부가 국산 백신과 기존 허가받은 코로나19 백신 간 효과와 안전성을 비교하는 방식의 '비교임상' 계획서 작성을 위한 표준안을 마련했다.
식품의약품안전처는 임상 1.2상, 일반적인 유효성 임상 3상, 비교 임상 3상 등 코로나19 백신 임상시험계획서 표준안 3종을 제공한다고 31일 밝혔다.
식약처가 국내 제약사의 코로나19 백신 개발을 지원키 위해 착수한 '우리 백신 프로젝트'의 일환이다.
현재까지 국내 5개 사가 코로나19 백신의 임상시험에 진입했다. 식약처는 지금부터 국산 백신의 임상 3상 진입과 상용화를 위해 특화된 지원이 필요하다고 보고 개발사들을 적극적으로 지원키로 했다.
그동안 백신은 수만 명의 시험대상자가 필요한 일반적인 유효성 임상 3상을 거쳐야 했다. 식약처 백신 심사 전문가들은 이미 허가된 백신과 개발 중인 백신을 중화항체가 같은 면역원성 지표로 비교하는 '면역원성 비교 3상' 설계를 제시했다.
이 방식을 이용하면 대규모 피험자와 위약대조군 모집 없이 수천 명 규모의 피시험자로 임상 3상 시험을 할 수 있다.
표준안에는 임상 단계별로 상세 기준을 구체적인 예시와 함께 담았다.
식약처는 "비교임상으로 검증한 우리 백신이 해외에서도 인정받을 수 있도록 세계보건기구(WHO) 회의 등 국제무대에서 비교임상 3상의 과학적 타당성과 규제에 대한 유연한 적용을 설득하겠다"고 밝혔다.
정윤영 작가 11번째 개인전 ‘Beyond Summer’ 개최 [이승준 기자] 동양 전통미술의 아름다움을 현대미술에 접목해 독특하고 우아한 회화 형식을 보여주는 정윤영 작가가 다음 달 13일부터 7월 4일까지 서울 역삼동 히든 엠 갤러리에서 11번째 개인전 ‘Beyond Summer(여름 너머)’을 연다.정 작가는 이번 전시회에서 식물에서 인간의 삶의 형태인 만남과 어울림을 형상화한 회화 20여점을 선보...

 충남 우수 농수산식품 동남아 수출길 확대
충남 우수 농수산식품 동남아 수출길 확대
 법원, 한명숙 손배소에 "불법 사찰 인정하나 시효 만료"
법원, 한명숙 손배소에 "불법 사찰 인정하나 시효 만료"
 인텔샛, 다중 궤도 기내 연결성 기능 일본항공에 제공
인텔샛, 다중 궤도 기내 연결성 기능 일본항공에 제공
 중기부, 인도네시아 자카르타서 한.아세안 스타트업 정책대화
중기부, 인도네시아 자카르타서 한.아세안 스타트업 정책대화
 이천시 가족센터 최유리 학생, ‘제15회 경기도 다문화가족 말하기 대회’ 이중언어 부문 장려상 수상
이천시 가족센터 최유리 학생, ‘제15회 경기도 다문화가족 말하기 대회’ 이중언어 부문 장려상 수상
 한길타임즈 CG
한길타임즈 CG
 [서평] 낮은 곳으로 흐르는 '사랑의 위력'
[서평] 낮은 곳으로 흐르는 '사랑의 위력'
 뉴진스 ‘How Sweet’, 역동적인 힙합 댄스 눈길…이게 바로 ‘뉴진스 쿨’
뉴진스 ‘How Sweet’, 역동적인 힙합 댄스 눈길…이게 바로 ‘뉴진스 쿨’
 인제 마스터즈 시리즈 2라운드 6월 1~2일 개최
인제 마스터즈 시리즈 2라운드 6월 1~2일 개최
 [독자기고] ‘기업유치를 위한 이천시의 특별한 제안’
[독자기고] ‘기업유치를 위한 이천시의 특별한 제안’
 굽이굽이 흐르는 청양 '지천 백리길'
굽이굽이 흐르는 청양 '지천 백리길'

 목록으로
목록으로